바이오
백신만으론 역부족…코로나19 치료제 '게임 체인저'의 조건
- 일상이 된 코로나19… 효과·편의·변이대응 갖춘 치료제는 아직
높은 '조건부 허가'의 벽… 신풍제약 등 승인 신청 대신 임상 3상에 도전

코로나19 발생 1년 8개월이 지난 현재, 코로나19는 일상을 파고들었다. 치명률은 낮아지는 듯 보이지만 전염력은 더 강해졌다. 개발된 백신의 보급은 지연됐고, 백신 접종자들에게도 돌파감염이 빈번하게 일어난다. 결국 코로나19 팬데믹을 끝내기 위해선 ‘게임 체인저’가 될 치료제가 필요하다는 게 다시 한번 입증됐다. 전 세계의 수많은 제약‧바이오 회사들은 게임체인저가 될 치료제 개발에 목을 매고 있다. 코로나19를 계기로 글로벌 시장에서 도약을 노리는 한국의 제약‧바이오 회사들도 마찬가지다.
‘국산 2호 치료제’ 노리는 제약사들, ‘조건부 허가’ 문턱 못 넘어
이 중 셀트리온의 렉키로나는 올해 2월 조건부 품목 허가를 얻어 ‘국산 1호’ 코로나19 치료제가 됐다. 이후 6개월이 지나도록 ‘국산 2호’ 신약은 나오지 못하고 있다. 14곳의 기업 중 셀트리온을 제외하고도 종근당, GC녹십자, 신풍제약, 부광약품, 대웅제약, 엔지켐생명과학 등이 임상 2상을 마쳤다. 하지만 이들은 아직 조건부 허가의 문턱을 넘진 못했다.
종근당은 지난 3월 나파벨탄의 조건부 승인을 신청했지만 식약처는 “유효성을 입증하지 못했다”고 결론 내렸다. 종근당은 이후 나파벨탄의 3상 시험계획을 승인받았다. 올해 4월 혈장치료제인 지코비딕주(GC5131)의 조건부 허가를 신청한 GC녹십자는 신청을 자진 철회했다.
7월 5일 피라맥스의 2상 톱라인을 발표한 신풍제약은 조건부 승인을 신청하지 않고 곧바로 임상 3상으로 향하기로 했다. 신풍제약은 “2상에서 1차 평가변수 목표치를 달성하지 못했지만 바이러스 억제 효과에 대한 전반적인 임상지표의 개선 가능성을 확인했다”며 “3상 시험을 통해 최대한 신속히 확증하는데 전사 역량을 집중할 예정”이라고 밝혔다.
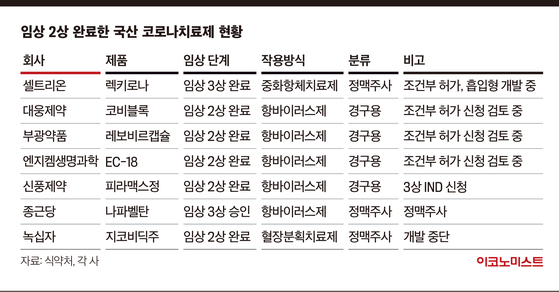
최근 두 번째 임상 2상을 마친 부광약품은 “두 번의 임상을 거쳐 데이터를 분석하고 있다”며 “정확한 시간을 말하긴 어렵지만 분석된 데이터를 바탕으로 관계기관과 협의를 진행할 것”이라고 설명했다.
아직 코로나19 치료제는 글로벌 시장에서도 ‘게임 체인저’라고 불릴 만한 약품이 나오지 못한 상황이다. 업계에선 확실한 치료 효과는 물론 복용 편의성과 변이바이러스에 대한 대응 능력 등이 모두 갖춰져야 글로벌 게임 체인저가 될 수 있을 것이라고 본다.
전 세계에서 가장 널리 쓰이고 있는 렘데시비르는 그 효과에 대해 지속적인 의문이 제기되고 있다. 렘데시비르의 경우 병원에서 정맥주사로 투여해야 하고, 효과가 제한적이라는 한계가 있다. 지난해 11월 세계보건기구(WHO)도 렘데시비르가 입원 환자들에게 “효과가 거의 없거나 아예 없다”며 사용 반대를 권고한 바 있다.
한국뿐 아니라 유럽에서 긴급사용 승인을 받고, 최근엔 인도네시아에 등 글로벌 시장에서 인정을 받는 렉키로나도 정맥 주사라는 복용방식이 약점으로 지목된다. 단일클론항체(하나의 항원결정기(epitope)에 특이적으로 결합하는 항체) 방식의 치료제이기 때문에 변이에 대해 지속 대응해야 한다는 과제도 안고 있다. 렉키로나 외 릴리와 리제네론, 글락소스미스클라인(GSK)의 항체 치료제는 모두 한 가지 이상 변이 대응에 실패해 칵테일 요법 등을 시행하고 있다. 이에 반해 렉키로나는 베타, 감마, 델타 변이에 대해 동물시험 등을 통해 유효성을 확인한 상태다.
글로벌 제약사들은 복용 편의성이 높은 ‘경구용’이나 ‘흡입형’ 치료제 개발에 집중하는 모습이다. 셀트리온은 최근 관련 특허 및 기술을 보유한 미국 소재 바이오기업인 인할론 바이오파마와 손잡고 흡입형 렉키로나 개발에 착수했다. 렉키로나의 경우 약효가 입증됐고, 현재까지 변이에 효능을 입증한 만큼 흡입형으로 개발이 완료된다면 코로나19에 효과적으로 대응할 수 있을 것으로 기대를 모은다. 아직 품목 허가를 받지는 못했지만 신풍제약, 대웅제약, 부광약품 등이 개발하는 치료제는 경구용이라 확실한 약효가 입증된다면 게임체인저가 될 수 있는 가능성은 있다.
‘글로벌 게임 체인저’ 못돼도 의미는 커
글로벌 임상 진행 역량과 경험을 갖춘 글로벌 제약회사들과 속도전에선 뒤처질 수밖에 없다는 게 냉혹한 현실이다. 그럼에도 국산 치료제 개발의 의미는 크다는 게 업계의 항변이다.
코로나19 치료제 개발 중인 국내 제약회사 한 관계자는 “미국의 선계약으로 추정하면 몰누피라비르의 가격은 10정에 80만원에 달해 환자와 건보재정에 타격이 불가피한데, 약물 재창출 방식의 국산 치료제는 이의 10분의 1의 가격에도 미치지 않는다”며 “국익을 위해서라도 치료제 개발에 나선 회사들을 응원해줘야 한다”고 주장했다.
최윤신 기자 choi.yoonshin@joongang.co.kr
ⓒ이코노미스트(https://economist.co.kr) '내일을 위한 경제뉴스 이코노미스트' 무단 전재 및 재배포 금지









![약 5분 만에 인생꿀팁 알려드립니다 ‘비치키’ [김지혜의 ★ 튜브]](https://image.isplus.com/data/isp/image/2025/04/27/isp20250427000053.400.0.jpg)
![“늘 마지막이라고 생각”… 예예, 미워할 수 없는 ‘킹’ 유발자 [IS인터뷰]](https://image.isplus.com/data/isp/image/2025/03/11/isp20250311000307.400.0.jpg)



당신이 좋아할 만한 기사
브랜드 미디어
브랜드 미디어
TiumBio and Biosolution Surge on Clinical Successes[K-Bio Pulse]
바이오 성공 투자, 1%를 위한 길라잡이팜이데일리
이데일리
팜이데일리
독수리 군단 미쳤다! 한화, 9연승으로 단독 선두
대한민국 스포츠·연예의 살아있는 역사 일간스포츠일간스포츠
일간스포츠
일간스포츠
할인도 경품도 '역대급'… 확! 달라진 '올댓트래블' 안보면 손해!
세상을 올바르게,세상을 따뜻하게이데일리
이데일리
이데일리
[단독]한화그룹, 美 워싱턴에 글로벌 방산 '지휘본부' 세웠다
성공 투자의 동반자마켓인
마켓인
마켓인
비만약에 150억 달러 투자 나선 화이자, 디앤디파마텍·인벤티지랩에 호재?
바이오 성공 투자, 1%를 위한 길라잡이팜이데일리
팜이데일리
팜이데일리