- [美 뚫는 바이오시밀러]①
민간 중심 시장 파편화…‘상호교환성’도 걸림돌
바이오시밀러 가격 대비 시장 점유율 높지 않아

의약품 가격 낮춰도 점유율 낮아
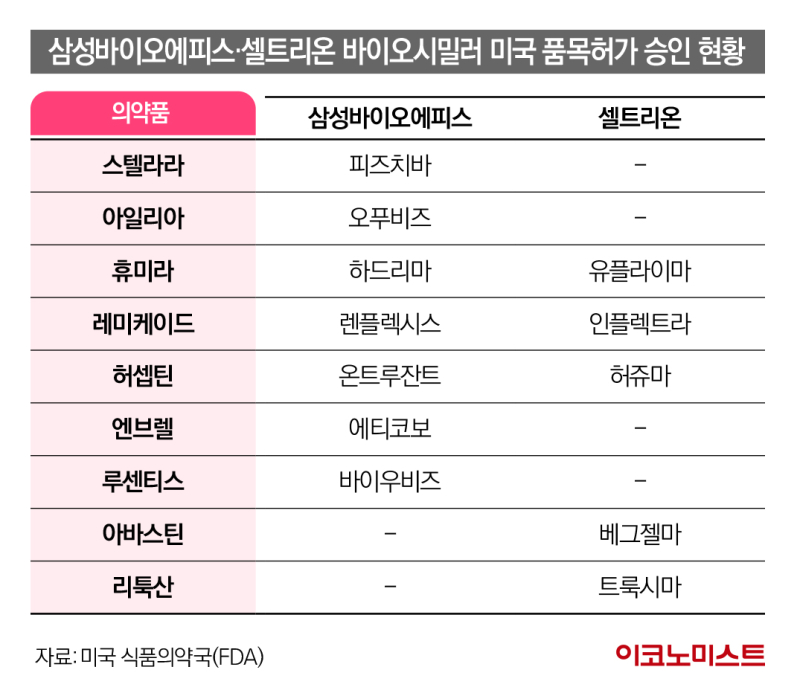
문제는 오리지널 의약품보다 낮은 가격에 공급되면서도 시장 점유율을 끌어올리지 못하는 경우다. 여러 시장조사기관의 자료를 종합하면 셀트리온의 허셉틴 바이오시밀러 허쥬마의 실제 판매 가격(ASP)은 1438달러(약 198만원)로 시장 점유율은 지난해 말을 기준으로 2% 수준이다. 이와 달리 오리지널 의약품인 허셉틴은 두 배에 달하는 3188달러(약 440만원)에 공급되며 16%의 시장 점유율을 유지하고 있다. 삼성바이오에피스도 상황은 다르지 않다. 이 회사의 허셉틴 바이오시밀러인 온트루잔트의 ASP는 1380달러(약 191만원)이고 시장 점유율은 6%에 그친다. 1611달러(약 222만원)의 ASP에 제품을 공급하는 미국 기업 마일란의 오기브리(11%)보다 시장 점유율이 낮다.
다른 바이오의약품도 상황은 다르지 않다. 삼성바이오에피스와 셀트리온 등이 바이오시밀러를 연달아 출시한 자가면역질환 치료제 레미케이드(성분명 인플릭시맙)는 지난해 말을 기준으로 오리지널 의약품이 시장의 46%가량을 차지한다. 셀트리온의 레미케이드 바이오시밀러인 인플렉트라가 시장 점유율을 28%로 끌어올렸지만, 삼성바이오에피스의 렌플렉시스와 암젠의 아브솔라 등은 10% 수준의 시장 점유율을 차지하고 있다. 레미케이드 바이오시밀러는 가격 차이도 크지 않다. 레미케이드의 ASP는 올해 초를 기준으로 303달러(약 42만원), 렌플렉시스는 291달러(약 40만원), 아브솔라는 231달러(약 32만원), 인플렉트라는 119달러(약 16만원) 정도다.
시장 규모가 큰 휴미라의 바이오시밀러 시장은 더 각축전이다. 휴미라는 여러 블록버스터 의약품 중에서 최근 특허가 만료됐고, 매출 규모는 가장 크다. 그만큼 바이오시밀러를 개발해 이 시장에서 매출을 올려보려는 기업 수요가 높다. 하지만 현재까지 휴미라 바이오시밀러를 출시한 기업들의 시장 지위는 낮다. 삼성바이오에피스와 암젠, 코헤루스, 베링거 인겔하임, 셀트리온, 프레지니우스 카비, 화이자 등은 앞다퉈 바이오시밀러를 시장에 내놓고도 지난해 말 기준 전체 시장의 1%조차 점유율을 확보하지 못했다. 바이오시밀러 기업이 차지하는 시장 점유율도 전체 시장의 2% 수준이다. 아바스틴(87%)과 허셉틴(84%), 리툭산(73%), 레미케이드(54%) 시장에서 바이오시밀러 제품이 차지하는 점유율에 한참을 못 미친다.
민간 중심 파편화된 美 시장
국내 기업이 미국의 바이오시밀러 시장에서 고전하는 이유는 민간 중심으로 시장이 파편화돼 있어서다. 정부 중심의 공급 체계가 상대적으로 단순한 유럽과 달리 미국은 보험사와 약제보험관리업체(PBM) 등 약품 공급에 관여하는 기관이 여럿이다. 이들 기관의 입장에 따라 선호하는 의약품도 다르고 리베이트도 활발하다. 미국 시장은 입찰을 통해 바이오시밀러를 조달하기 때문에 ‘가격’이 핵심인 유럽 시장과 다르다는 뜻이다. 유럽 시장에서 높은 시장 점유율을 차지한 바이오시밀러가 미국 시장에서 맥을 못 추는 이유도 마찬가지다. 미국에서는 약국에서 특정 의약품만 오리지널 의약품을 대체할 수 있다는 점도 바이오시밀러의 시장 점유율을 낮추는 요인이다. 유럽에서는 성분이 같다면 오리지널 의약품 대신 약국 차원에서 바이오의약품을 환자에게 공급할 수 있다.
다만 이런 시장 지형은 세계 각국 정부가 바이오시밀러의 사용을 확대하는 제도를 내놓으며 변화하고 있다. 오리지널 의약품을 바이오시밀러 제품으로 대체했을 때, 안전성이나 치료 효능이 줄어드는 위험은 미미하다고 FDA는 판단했다. 이에 따라 FDA는 최근 기업이 ‘상호교환성’을 연구하지 않도록 하는 지침 개정 논의 작업에 들어갔다. 상호교환성 연구는 환자가 약국에서 오리지널 의약품을 대체해 받을 수 있는 바이오의약품으로 지정받기 위한 절차다. 사라 임 FDA 치료용 바이오의약품·바이오시밀러 국장은 “상호교환성이 인정된 바이오시밀러와 그렇지 않은 바이오시밀러를 모두 검토한 결과 두 제품 모두 오리지널 의약품만큼 안전하고 효과적”이라고 말했다.
ⓒ이코노미스트(https://economist.co.kr) '내일을 위한 경제뉴스 이코노미스트' 무단 전재 및 재배포 금지










![버스 타다가 엉엉... 지예은 닮은 꼴 ‘쓰까르’, 매력 넘치네 [김지혜의 ★튜브]](https://image.isplus.com/data/isp/image/2025/08/26/isp20250826000291.400.0.jpg)
![‘채널주인부재중’으로 본 크리에이터 생존 전략 [김지혜의 ★튜브]](https://image.isplus.com/data/isp/image/2025/07/27/isp20250727000081.400.0.jpg)



당신이 좋아할 만한 기사
브랜드 미디어
브랜드 미디어
싸이만 그랬을까?…비대면 마약류 처방 충격 실태
세상을 올바르게,세상을 따뜻하게이데일리
이데일리
이데일리
이숭용 감독, SSG와 2+1년 재계약...까닭은?
대한민국 스포츠·연예의 살아있는 역사 일간스포츠일간스포츠
일간스포츠
일간스포츠
우원식 “7년 만에 봅니다” 인사에...김정은 의외의 반응
세상을 올바르게,세상을 따뜻하게이데일리
이데일리
이데일리
[마켓인]준오헤어 품은 블랙스톤?…'대규모 투자' 두고 엇갈린 해석
성공 투자의 동반자마켓인
마켓인
마켓인
고바이오랩, ‘주사 대신 자연 GLP-1…비만 치료제 판도 흔드나[바이오맥짚기]
바이오 성공 투자, 1%를 위한 길라잡이팜이데일리
팜이데일리
팜이데일리