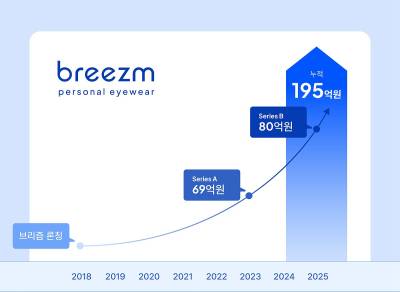
바이오
에이비엘바이오의 협력 기업인 미국의 콤패스테라퓨틱스가 진행성 담도암 치료제 후보물질 CTX-009(ABL001)의 임상 2·3상 톱라인 결과를 올해 3월 말 공개한다. 톱라인 결과는 임상의 성패 여부를 알 수 있는 데이터를 말한다.이상훈 에이비엘바이오 대표는 23일 온라인 기업설명회를 통해 “콤파스테라퓨틱스가 이르면 올해 3월 말 CTX-009의 임상 2·3상 톱라인 결과를 공개한다”라며 “CTX-009는 2차 치료제로 사용 시 담도암 시장 점유율 2위에 오를 것이라는 평가를 받은 만큼 2026년 가속 승인을 통한 빠른 상용화와 기술료(로열티) 수령을 기대한다”고 말했다. 이 대표는 미국 텍사스대 MD앤더슨 암센터가 CTX-009을 담도암 1차 치료제로 활용하기 위한 연구자 주도 임상을 진행한 점도 향후 CTX-009의 물질 가치를 높일 것이라고 평가했다. 해당 임상을 통해 CTX-009을 1차 치료제로 사용할 가능성이 확인되면 미국암종합네트워크(NCCN) 지침에 포함될 공산이 커서다. NCCN 지침은 암 환자를 치료할 때 쓰이는 자료다.CTX-009는 이중항체 후보물질로 VEGF-A와 DLL4를 동시에 표적한다. 암 조직 내 신생혈관이 생성되지 못하도록 해 암세포를 죽인다. 콤패스테라퓨틱스는 미국에서 담도암 환자를 대상으로 CTX-009과 항암제 파클리탁셀을 병용하는 임상 2·3상을 진행하고 있다. DLL4가 양성인 대장암 환자로 대상을 좁혀 병용 임상 2상도 진행할 계획이다.CTX-009가 담도암 외 대장암으로 적응증을 확대하면 약물 가치도 높아질 것이라고 이 대표는 설명했다. 대장암은 미국에서 사망률이 두 번째로 높은 암으로도 알려져 있다. 미국과 일본에서 매년 15만명의 환자가 발생하는 것으로도 추산된다. 이 대표는 “CTX-009가 기존 치료제인 아바스틴보다 좋은 결과를 내면 CTX-009의 물질 가치를 높일 것”이라고 했다.차세대 이중항체 ADC 집중에이비엘바이오는 CTX-009 외 이중항체에 항체-약물 접합체(ADC)를 결합하는 연구개발(R&D)에도 속도를 내기 위해 미국에 에이비엘바이오USA를 설립했다. 이곳에서 전문 인력을 채용해 이중항체 ADC 개발에 전력을 다한다는 구상이다. 에이비엘바이오USA는 비임상 단계의 이중항체 ADC 후보물질 ABL206, ABL209, ABL210의 개발을 담당한다.에이비엘바이오는 이들 후보물질을 비소세포폐암 치료제로 개발한다는 구상이다. 난소암, 췌장암, 식도암, 두경부암, 위암, 방광암, 대장암 등도 적응증으로 검토 중이다. ABL206은 올해 9월, ABL209는 올해 12월 임상시험 허가를 신청한다. 현재 임상 물질 생산과 독성시험을 진행 중이다. ABL210은 2026년 상반기 임상시험 허가를 신청한다. 곧 독성시험도 진행한다.이 대표는 “에이비엘바이오 그동안 이중항체 분야에서 탄탄한 경험을 쌓은 만큼 ABL20X 시리즈로 난소암, 대장암, 방광암, 폐암 등 고형암 환자가 투여할 수 있는 이중항체 ADC를 개발하겠다”이라며 “이를 잘 개발한다면 이들 물질이 2027년 이후 에이비엘바이오의 파이프라인에서 중요한 역할을 담당하고 있을 것”이라고 했다.


















![“늘 마지막이라고 생각”… 예예, 미워할 수 없는 ‘킹’ 유발자 [IS인터뷰]](https://image.isplus.com/data/isp/image/2025/03/11/isp20250311000307.400.0.jpg)
![인터스텔라 한 편 뚝딱... 집에서 보는 ‘실감나는 우주’ [김지혜의 ★튜브]](https://image.isplus.com/data/isp/image/2025/03/16/isp20250316000120.400.0.jpg)